Νέα περισσότερο μακροπρόθεσμα δεδομένα ανακοινώθηκαν σήμερα για τον αναστολέα της πρωτεΐνης προγραμματισμένου κυτταρικού θανάτου PD-1, cemiplimab, από μία πιλοτική μελέτη Φάσης 2 στο προχωρημένο πλακώδες καρκίνωμα του δέρματος, τον πιο θανατηφόρο μη μελανωματικό καρκίνο του δέρματος.
Τα αποτελέσματα αυτά δείχνουν μεγαλύτερης διάρκειας και υψηλότερα ποσοστά πλήρους ανταπόκρισης (CR) από εκείνα που έχουν αναφερθεί στο παρελθόν. Επιπλέον, τα δεδομένα ανήκουν στο μεγαλύτερο και πιο ώριμο σύνολο προοπτικών κλινικών δεδομένων σε ασθενείς με μεταστατικό πλακώδες καρκίνωμα του δέρματος (mCSCC) ή τοπικά προχωρημένο πλακώδες καρκίνωμα του δέρματος (laCSCC), οι οποίοι δεν είναι υποψήφιοι για χειρουργική επέμβαση ή ακτινοθεραπεία, που έχουν στόχο την ίαση.
Τα δεδομένα παρουσιάστηκαν στο πλαίσιο του φετινού συνεδρίου της Αμερικανικής Εταιρείας Κλινικής Ογκολογίας (ASCO 2020) το οποίο διεξήχθη διαδικτυακά.
«Τα δεδομένα τριετούς παρακολούθησης καταδεικνύουν σημαντικά μακροπρόθεσμα αποτελέσματα με το cemiplimab, το οποίο αποτελεί πλέον την καθιερωμένη θεραπεία για ασθενείς με προχωρημένο πλακώδες καρκίνωμα του δέρματος σε πολλές χώρες», δήλωσε ο Δρ. Danny Rischin, Διευθυντής του Τμήματος Κλινικής Ογκολογίας στο Αντικαρκινικό Κέντρο Peter MacCallum στη Βικτόρια της Αυστραλίας. «Τα δεδομένα του cemiplimab σχετικά με τη διάρκεια ανταπόκρισης και τη συνολική επιβίωση προσφέρουν σημαντικές νέες πληροφορίες για τη μακροπρόθεσμη θεραπεία του προχωρημένου πλακώδους καρκινώματος του δέρματος, με τη διάμεση τιμή να μην έχει επιτευχθεί ακόμα για καμία από τις δύο παραμέτρους. Μάλιστα, είναι συναρπαστικό να βλέπουμε τον αριθμό των ασθενών που εμφανίζουν πλήρη ανταπόκριση να αυξάνεται κατά τη μεγαλύτερης διάρκειας παρακολούθηση, γεγονός που ενισχύει το δυνητικό συνεχιζόμενο όφελος της θεραπείας με cemiplimab σε αυτόν τον επιθετικό τύπο καρκίνου του δέρματος».
Με παρακολούθηση διάρκειας έως και τριών ετών, αποτελέσματα από την πιλοτική μελέτη Φάσης 2 έδειξαν ότι το 46% των ασθενών (95% CI: 39%-53%) εμφάνισε συρρίκνωση του όγκου μετά τη λήψη θεραπείας με cemiplimab, με διάμεσο χρόνο έως την ανταπόκριση 2 μήνες (ενδοτεταρτημοριακό εύρος: 2-4 μήνες). Επιπλέον, περισσότεροι ασθενείς (16%) είδαν τον όγκο τους να εξαφανίζεται εντελώς με την πάροδο του χρόνου σε σύγκριση με προηγούμενες αναλύσεις. Μεταξύ των ασθενών με μεταστατική νόσο, οι οποίοι είχαν και το πιο μακροχρόνιο διάστημα παρακολούθησης στη μελέτη (Ομάδα 1 στον πίνακα παρακάτω), το 20% αυτών έχει πλέον πετύχει πλήρη ανταπόκριση (CR), σημειώνοντας αύξηση σε σχέση με το 7% που καταγράφηκε στην πρωταρχική ανάλυση του 2017. Στους ασθενείς που πέτυχαν πλήρη ανταπόκριση σε οποιαδήποτε ομάδα, ο διάμεσος χρόνος έως την πλήρη ανταπόκριση ήταν 11 μήνες (ενδοτεταρτημοριακό εύρος: 7-15 μήνες). Η διάμεση συνολική επιβίωση και η διάμεση διάρκεια ανταπόκρισης δεν έχουν επιτευχθεί ακόμη για καμία από τις ομάδες θεραπείας.
Τα αποτελέσματα ανά ομάδα θεραπείας ήταν τα εξής:
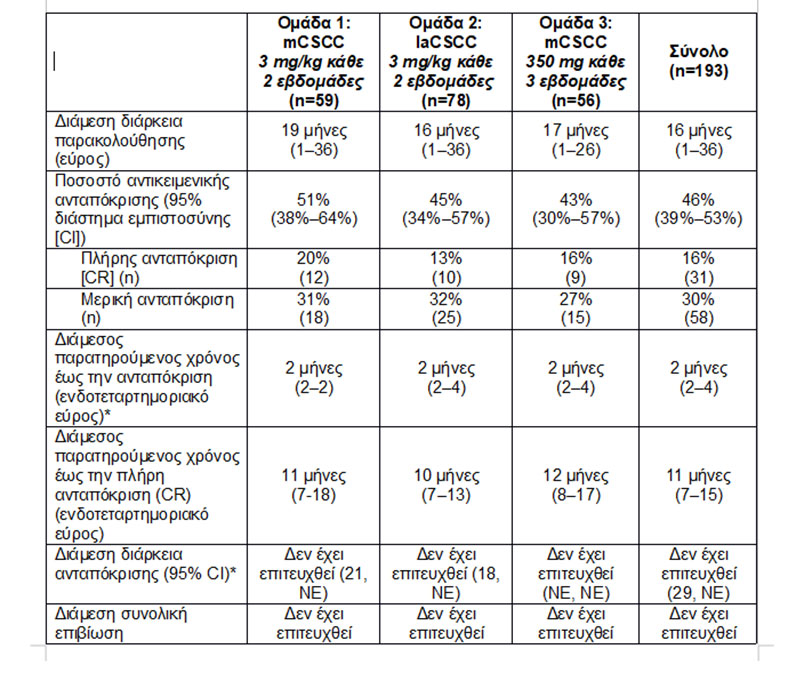
NE = μη αξιολογήσιμο
*Με βάση τον αριθμό των ασθενών με επιβεβαιωμένη πλήρη ή μερική ανταπόκριση και τις εκτιμήσεις Kaplan-Meier.
Τα ποσοστά πλήρους ανταπόκρισης (CR) με την πάροδο του χρόνου ήταν τα εξής:
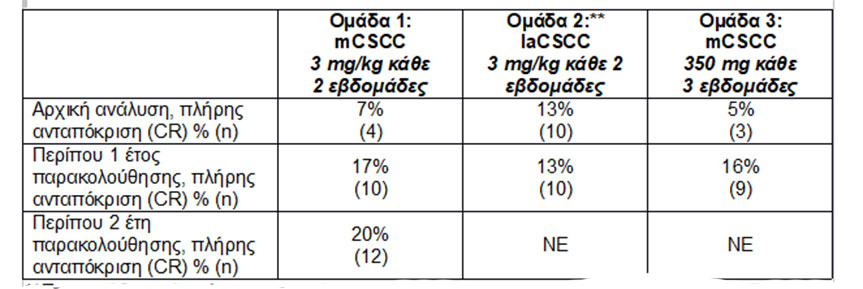
*Στους 23 ασθενείς με τοπικά προχωρημένο πλακώδες καρκίνωμα του δέρματος (laCSCC) οι οποίοι συμπεριλήφθηκαν στην προκαθορισμένη ενδιάμεση ανάλυση της Ομάδας 2, δεν καταγράφηκε πλήρης ανταπόκριση.
Δεν αναγνωρίστηκαν νέα ευρήματα ασφάλειας. Οι πιο συχνές σχετιζόμενες με τη θεραπεία ανεπιθύμητες ενέργειες (AEs) ήταν κόπωση (35%), διάρροια (28%) και ναυτία (24%). Οι πιο συχνές σχετιζόμενες με τη θεραπεία ανεπιθύμητες ενέργειες βαθμού 3 ή υψηλότερου ήταν πνευμονίτιδα (3%), αυτοάνοση ηπατίτιδα (2%), αναιμία, κολίτιδα και διάρροια (καθεμία 1%). Δεν αναφέρθηκαν νέες ανεπιθύμητες ενέργειες που οδηγούν σε θάνατο σε σύγκριση με προηγούμενες αναφορές.
Πέρα από τα επικαιροποιημένα δεδομένα αποτελεσματικότητας και ασφάλειας, παρουσιάστηκε για πρώτη φορά μια ξεχωριστή ανάλυση post-hoc των εκβάσεων της σχετιζόμενης με την υγεία ποιότητας ζωής (HRQL) από τη μελέτη Φάσης 2. Η μεγάλη πλειονότητα (83%) των ασθενών ανέφερε βελτιωμένη ή σταθερή συνολική σχετιζόμενη με την υγεία ποιότητα ζωής (HRQL) και το 43% των ασθενών εμφάνισε μια κλινικά σημαντική μείωση του πόνου σε διάστημα 4 μηνών θεραπείας. Η ανάλυση βασίστηκε στις απαντήσεις των ασθενών στο ειδικά σχεδιασμένο για τον καρκίνο Ερωτηματολόγιο 30 ερωτήσεων για την σχετιζόμενη με την υγεία ποιότητα ζωής (QLQ-C30) του Ευρωπαϊκού Οργανισμού για την Έρευνα και τη Θεραπεία του Καρκίνου.
Στην ανοιχτή, μονού σκέλους, διεθνή, πιλοτική κλινική μελέτη φάσης 2 (Μελέτη 1540) εντάχθηκαν 193 ασθενείς με τοπικά προχωρημένο πλακώδες καρκίνωμα του δέρματος ή μεταστατικό πλακώδες καρκίνωμα του δέρματος, οι οποίοι δεν ήταν υποψήφιοι για χειρουργική επέμβαση ή ακτινοθεραπεία, που έχουν στόχο την ίαση. Η αρχική πρωτογενής ανάλυση της μελέτης, σε συνδυασμό με αποτελέσματα από μία μελέτη Φάσης 1 (Μελέτη 1423), αποτέλεσε τη βάση για την έγκριση του cemiplimab από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ στα τέλη του 2018. Αυτές οι δύο μελέτες αντιπροσωπεύουν το μεγαλύτερο και πιο ώριμο σύνολο προοπτικών κλινικών δεδομένων στο προχωρημένο πλακώδες καρκίνωμα του δέρματος.
Το πλακώδες καρκίνωμα του δέρματος αποτελεί τη δεύτερη πιο συχνή μορφή καρκίνου του δέρματος παγκοσμίως, καθώς αντιστοιχεί σε σχεδόν 20% όλων των τύπων καρκίνου του δέρματος, ενώ ο αριθμός των νεοδιαγνωσθέντων περιστατικών αναμένεται ότι θα αυξηθεί σημαντικά σε πολλές χώρες. Μολονότι η πρόγνωση για τους ασθενείς με πλακώδες καρκίνωμα του δέρματος είναι καλή εφόσον διαγνωστεί σε πρώιμο στάδιο, ο καρκίνος ενδέχεται να είναι ιδιαίτερα δύσκολο να αντιμετωπιστεί αποτελεσματικά σε προχωρημένα στάδια και οι ασθενείς μπορεί να εμφανίσουν μειωμένη ποιότητα ζωής λόγω των επιπτώσεων της εξέλιξης της νόσου. Παρόλο που οι εκτιμήσεις ποικίλλουν, πηγές καταδεικνύουν ότι 7.000 ασθενείς χάνουν τη ζωή τους κάθε χρόνο στις ΗΠΑ εξαιτίας του προχωρημένου πλακώδους καρκινώματος του δέρματος, αριθμός παρόμοιος με των ατόμων που καταλήγουν λόγω μελανώματος.
Το cemiplimab είναι ένα πλήρως ανθρώπινο μονοκλωνικό αντίσωμα που στοχεύει τον υποδοχέα ανοσολογικών σημείων ελέγχου της πρωτεΐνης προγραμματισμένου κυτταρικού θανάτου (PD-1) στην επιφάνεια των T-κυττάρων. Μέσω της πρόσδεσής του στην PD-1, το cemiplimab έχει δείξει ότι δεν επιτρέπει στα καρκινικά κύτταρα να χρησιμοποιούν το μονοπάτι σηματοδότησης της PD-1 για την καταστολή της ενεργοποίησης των T-κυττάρων.
Το cemiplimab είναι η πρώτη και μοναδική εγκεκριμένη ανοσοθεραπεία στις ΗΠΑ, στην Ευρωπαϊκή Ένωση και σε άλλες χώρες για ενήλικες με μεταστατικό πλακώδες καρκίνωμα του δέρματος ή τοπικά προχωρημένο πλακώδες καρκίνωμα του δέρματος οι οποίοι δεν είναι υποψήφιοι για χειρουργική επέμβαση ή ακτινοθεραπεία που έχουν στόχο την ίαση.
Το εκτενές κλινικό πρόγραμμα για το cemiplimab επικεντρώνεται σε τύπους καρκίνου που είναι δύσκολο να αντιμετωπιστούν. Στον καρκίνο του δέρματος, το πρόγραμμα περιλαμβάνει μία πιλοτική κλινική μελέτη για το προχωρημένο βασικοκυτταρικό καρκίνο (BCC) και επιπλέον μελέτες επικουρικής και νέο-επικουρικής θεραπείας του πλακώδους καρκίνου του δέρματος. Το cemiplimab διερευνάται επίσης σε κλινικές μελέτες φάσης 3 για τον μη-μικροκυτταρικό καρκίνο του πνεύμονα και τον καρκίνο του τραχήλου της μήτρας, όπως επίσης και σε μελέτες που συνδυάζουν το cemiplimab με καινοτόμες νέες θεραπευτικές προσεγγίσεις τόσο για συμπαγείς όγκους όσο και για αιματολογικές κακοήθειες. Οι εν λόγω δυνητικές χρήσεις είναι υπό έρευνα και η ασφάλεια και η αποτελεσματικότητά τους δεν έχουν αξιολογηθεί από καμία ρυθμιστική αρχή.




