Η Ευρωπαϊκή Επιτροπή (ΕΕ) ενέκρινε το inclisiran για τη θεραπεία ενηλίκων με υπερχοληστερολαιμία ή μικτή δυσλιπιδαιμία.
Η έγκριση βασίστηκε στα αποτελέσματα του ισχυρού προγράμματος κλινικής ανάπτυξης ORION, όπου το inclisiran παρείχε αποτελεσματική και διατηρούμενη μείωση των επιπέδων της χοληστερόλης χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-C) έως και κατά 52% σε ασθενείς με αυξημένες τιμές LDL-C, παρά τη λήψη θεραπείας με στατίνη στη μέγιστη ανεκτή δόση.
Με χορήγηση δύο δόσεων ετησίως, μετά από τη χορήγηση μίας αρχικής δόσης και μίας επόμενης δόσης στους 3 μήνες, το inclisiran αναμένεται να υποστηρίξει τη μακροχρόνια συμμόρφωση.
Το inclisiran είναι ένα πρώτο στην κατηγορία του μικρό παρεμβαλλόμενο RNA (siRNA) που παρέχει αποτελεσματική και διατηρούμενη μείωση των επιπέδων της LDL-C σε ασθενείς με αθηροσκληρωτική καρδιαγγειακή νόσο (ASCVD), νόσο ισοδύναμου κινδύνου με ASCVD και ετερόζυγη οικογενή υπερχοληστερολαιμία (HeFH), οι οποίες αποτελούν σημαντικότατες αιτίες καρδιακών προσβολών, αγγειακών εγκεφαλικών επεισοδίων και μπορεί τελικά να καταλήξουν στον θάνατο.
«Η μακροχρόνια έκθεση σε επίμονα αυξημένες τιμές LDL-C αυξάνει τον κίνδυνο για ASCVD8, που μπορεί να οδηγήσει σε καρδιαγγειακό σύμβαμα, όπως καρδιακή προσβολή ή αγγειακό εγκεφαλικό επεισόδιο. Ως το πρώτο και μοναδικό siRNA που παρέχει αποτελεσματική και διατηρούμενη μείωση των επιπέδων της LDL-C, το inclisiran θα δώσει την ευκαιρία να αλλάξει ο τρόπος με τον οποίο αντιμετωπίζονται οι υψηλές τιμές της LDL-C, η οποία αποτελεί έναν εξαιρετικά σημαντικό τροποποιήσιμο παράγοντα κινδύνου για την ASCVD. Δεδομένου ότι χορηγείται μόνο δύο φορές τον χρόνο από επαγγελματίες υγείας, το inclisiran αναμένεται ότι θα παρακάμψει τις προκλήσεις της συμμόρφωσης στη θεραπεία, βελτιώνοντας τη θεραπευτική κάλυψη και διατήρηση», εξηγεί ο καθηγητής Ulf Landmesser, M.D., διευθυντής του Charité Center for Cardiovascular Diseases στο Βερολίνο.
Το inclisiran έχει εγκριθεί για τη θεραπεία ενηλίκων με πρωτοπαθή υπερχοληστερολαιμία (ετερόζυγη οικογενή και μη οικογενή) ή μικτή δυσλιπιδαιμία, ως προσθήκη στη διατροφή:
• σε συνδυασμό με στατίνη ή στατίνη μαζί με άλλες θεραπείες μείωσης των επιπέδων των λιπιδίων σε ασθενείς που αδυνατούν να επιτύχουν τους στόχους ως προς την LDL-C με τη μέγιστη ανεκτή δόση στατίνης ή
• σε μονοθεραπεία ή σε συνδυασμό με άλλες θεραπείες μείωσης των επιπέδων των λιπιδίων σε ασθενείς που εμφανίζουν μη ανοχή στις στατίνες ή για τους οποίους αντενδείκνυνται οι στατίνες.
Η άδεια κυκλοφορίας της ΕΕ ισχύει για τις 27 χώρες που είναι μέλη της ΕΕ. Η Νορβηγία, η Ισλανδία και το Λιχτενστάιν, ως κράτη μέλη του Ευρωπαϊκού Οικονομικού Χώρου (ΕΟΧ), θα λάβουν αντίστοιχες αποφάσεις με βάση τη σύσταση της ΕΕ.
Το inclisiran είναι επίσης υπό εξέταση από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ για ενήλικες που έχουν αυξημένα επίπεδα LDL-C, ενόσω συνεχίζουν να λαμβάνουν θεραπεία με στατίνη στη μέγιστη ανεκτή δόση.
Σχετικά με τις μελέτες ORION Φάσης ΙΙΙ για τη μείωση της LDL-C
Η ORION-9 ήταν μία κύρια φάσης ΙΙΙ, ελεγχόμενη με εικονικό φάρμακο, διπλά τυφλή, τυχαιοποιημένη μελέτη , για την αξιολόγηση της αποτελεσματικότητας, της ασφάλειας και της ανεκτικότητας του άλατος νατριούχου inclisiran 300 mg, ισοδύναμο με 284 mg inclisiran, που χορηγήθηκε υποδορίως από επαγγελματία υγείας. Ξεκινώντας με τη χορήγηση μίας αρχικής δόσης, το inclisiran χορηγήθηκε κατόπιν ξανά στους 3 μήνες και, στη συνέχεια και εφεξής, κάθε 6 μήνες, σε 482 συμμετέχοντες με κλινική ή γενετική ένδειξη ετερόζυγης οικογενούς υπερχοληστερολαιμίας (HeFH) και αυξημένα επίπεδα χοληστερόλης χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-C), παρά τη λήψη θεραπειών μείωσης των επιπέδων της LDL-C στη μέγιστη ανεκτή δόση (π.χ., στατίνη ή εζετιμίμπη). Στα πρωτεύοντα καταληκτικά σημεία της ORION-9, το inclisiran επέφερε μέση προσαρμοσμένη ως προς το εικονικό φάρμακο ποσοστιαία μεταβολή των μειώσεων των επιπέδων της LDL-C της τάξης του 48% (P<0,0001) στους 17 μήνες και επέδειξε προσαρμοσμένη ως προς τον χρόνο ποσοστιαία μεταβολή των μειώσεων των επιπέδων της LDL-C κατά 44% (P<0,0001) από τους 3 έως τους 18 μήνες. Η διεθνής μελέτη διεξήχθη σε 46 ερευνητικά κέντρα σε οκτώ χώρες.
Η ORION-10 ήταν μία κύρια φάσης ΙΙΙ, ελεγχόμενη με εικονικό φάρμακο, διπλά τυφλή, τυχαιοποιημένη μελέτη, για την αξιολόγηση της αποτελεσματικότητας, της ασφάλειας και της ανεκτικότητας του άλατος νατριούχου inclisiran 300 mg, ισοδύναμο με 284 mg inclisiran, που χορηγήθηκε υποδορίως από επαγγελματία υγείας. Ξεκινώντας με τη χορήγηση μίας αρχικής δόσης2, το inclisiran χορηγήθηκε κατόπιν ξανά στους 3 μήνες και, στη συνέχεια και εφεξής, κάθε 6 μήνες, σε 1.561 συμμετέχοντες με αθηροσκληρωτική καρδιαγγειακή νόσο (ASCVD) και αυξημένα επίπεδα LDL-C, παρά τη λήψη θεραπειών μείωσης των επιπέδων της LDL-C στη μέγιστη ανεκτή δόση (π.χ. στατίνη ή/και εζετιμίμπη). Στα πρωτεύοντα καταληκτικά σημεία της ORION-10, το inclisiran επέφερε μέση προσαρμοσμένη ως προς το εικονικό φάρμακο ποσοστιαία μεταβολή των μειώσεων των επιπέδων της LDL-C κατά 52% (P<0,0001) στους 17 μήνες και επέδειξε προσαρμοσμένη ως προς τον χρόνο ποσοστιαία μεταβολή των μειώσεων των επιπέδων της LDL-C κατά 54% (P<0,0001) από τους 3 έως τους 18 μήνες. Η μελέτη διεξήχθη σε 145 ερευνητικά κέντρα στις Ηνωμένες Πολιτείες.
Η ORION-11 ήταν μία κύρια φάσης ΙΙΙ, ελεγχόμενη με εικονικό φάρμακο, διπλά τυφλή, τυχαιοποιημένη μελέτη, για την αξιολόγηση της αποτελεσματικότητας, της ασφάλειας και της ανεκτικότητας του άλατος νατριούχου inclisiran 300 mg, ισοδύναμο με 284 mg inclisiran, που χορηγήθηκε υποδορίως από επαγγελματία υγείας. Ξεκινώντας με τη χορήγηση μίας αρχικής δόσης2, το inclisiran χορηγήθηκε κατόπιν ξανά στους 3 μήνες και, στη συνέχεια και εφεξής, κάθε 6 μήνες, σε 1.617 ασθενείς με ASCVD ή ισοδύναμου κινδύνου με ASCVD και αυξημένα επίπεδα LDL-C, παρά τη λήψη θεραπείας με στατίνη στη μέγιστη ανεκτή δόση (με ή χωρίς εζετιμίμπη). Στα πρωτεύοντα καταληκτικά σημεία της ORION-11, το inclisiran επέφερε προσαρμοσμένη ως προς το εικονικό φάρμακο μεταβολή των μειώσεων των επιπέδων της LDL-C της τάξης του 50% (P<0,0001) στους 17 μήνες και επέδειξε προσαρμοσμένες ως προς τον χρόνο μειώσεις των επιπέδων της LDL-C κατά 49% (P<0,0001) από τους 3 έως τους 18 μήνες. Η διεθνής μελέτη διεξήχθη σε 70 ερευνητικά κέντρα σε επτά χώρες.
Σχετικά με την αθηροσκληρωτική καρδιαγγειακή νόσο (ASCVD)
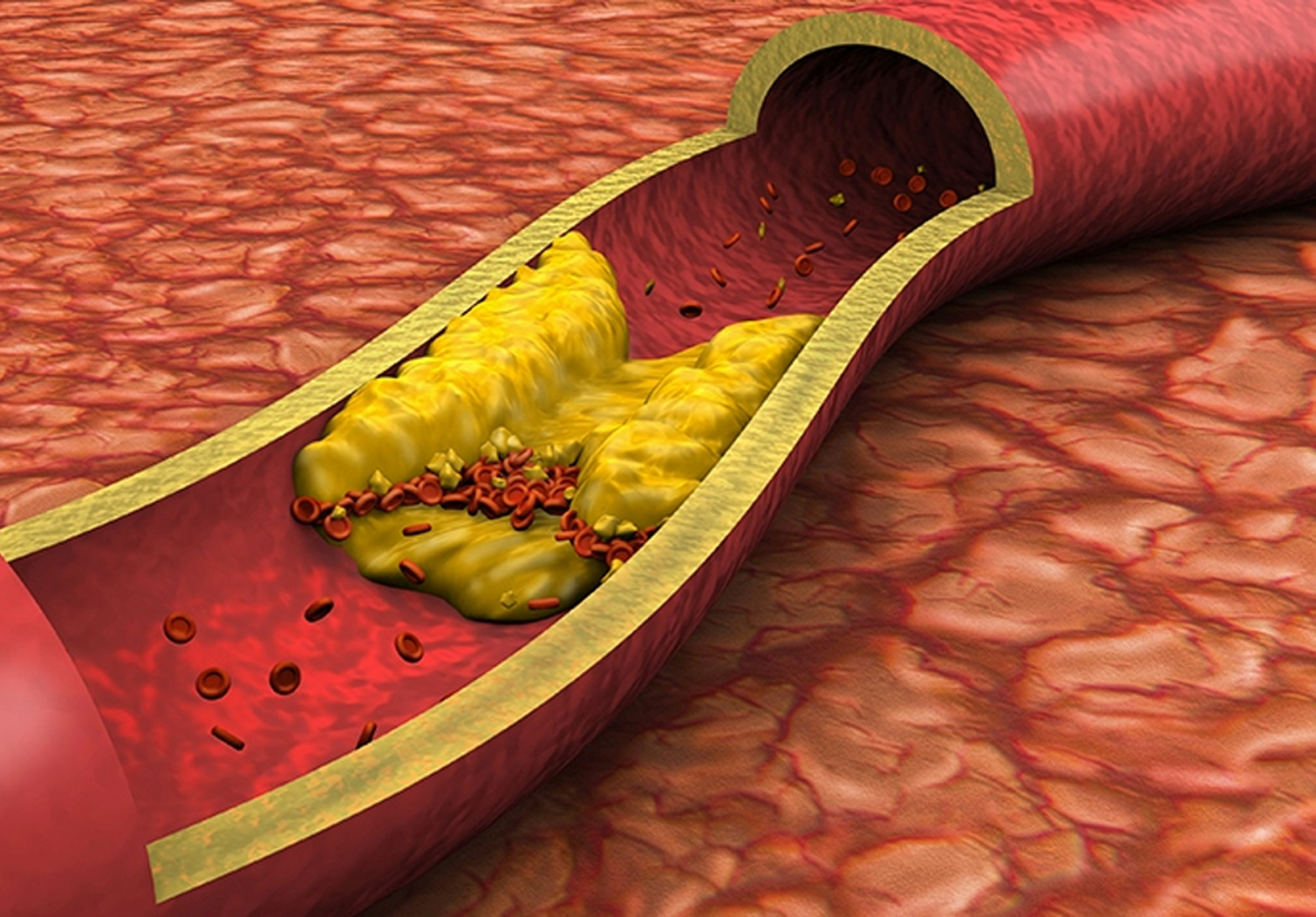
Η αθηροσκλήρωση είναι η συσσώρευση λιπιδίων, κυρίως χοληστερόλης χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-C), στον εσωτερικό χιτώνα των αρτηριών, η οποία επέρχεται με την πάροδο του χρόνου. Η αναπάντεχη ρήξη μίας αθηροσκληρωτικής πλάκας μπορεί να προκαλέσει αθηροσκληρωτικό καρδιαγγειακό σύμβαμα, όπως καρδιακή προσβολή ή αγγειακό εγκεφαλικό επεισόδιο. Η ASCVD ευθύνεται για παραπάνω από 85% όλων των θανάτων εξαιτίας καρδιαγγειακής νόσου. Η ASCVD είναι η κύρια αιτία θανάτου στην Ευρωπαϊκή Ένωση και το φορτίο της νόσου στις Ηνωμένες Πολιτείες είναι μεγαλύτερο από αυτό οποιασδήποτε άλλης χρόνιας νόσου. Ο όρος «νόσοι ισοδύναμου κινδύνου με ASCVD» αντιστοιχεί σε παθήσεις που ενέχουν παρόμοιο κίνδυνο για σύμβαμα ASCVD (π.χ., διαβήτης, ετερόζυγη οικογενής υπερχοληστερολαιμία).
Σχετικά με το inclisiran
Το inclisiran (KJX839) είναι η πρώτη και μοναδική θεραπεία με μικρό παρεμβαλλόμενο RNA (siRNA) για τη μείωση των επιπέδων της χοληστερόλης χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-C) μέσω ενός μηχανισμού δράσης παρεμβολής RNA (RNAi) και θα μπορούσε να βοηθήσει στη βελτίωση των εκβάσεων των ασθενών με αθηροσκληρωτική καρδιαγγειακή νόσο (ASCVD), που είναι μία θανατηφόρος μορφή καρδιαγγειακής νόσου. Χορηγούμενο σε δύο δόσεις ετησίως και επιτυγχάνοντας μία αποτελεσματική και παρατεταμένη μείωση των επιπέδων της LDL-C, το inclisiran δρα συμπληρωματικά στις στατίνες. Το inclisiran δρα διαφορετικά από άλλες θεραπείες εμποδίζοντας την παραγωγή της πρωτεΐνης στόχου στο ήπαρ, αυξάνοντας την ηπατική πρόσληψη της LDL-C και απομακρύνοντάς την από την κυκλοφορία. Το inclisiran έχει μία αρχική χορήγηση, χορηγείται ξανά στους 3 μήνες και, στη συνέχεια και εφεξής, κάθε 6 μήνες. Σε τρεις κλινικές δοκιμές, οι ασθενείς που λάμβαναν inclisiran διατήρησαν τη μείωση των επιπέδων της LDL-C καθ’ όλη τη διάρκεια του μεσοδιαστήματος των 6 μηνών μεταξύ των δόσεων. Δεδομένου ότι χορηγείται στο ιατρείο ως υποδόρια ένεση, το inclisiran αναμένεται να ενσωματωθεί απρόσκοπτα στην τακτική φροντίδα υγείας του ασθενούς.
Σε δοκιμές Φάσης ΙΙΙ, το inclisiran ήταν καλά ανεκτό. Οι πιο συχνές ανεπιθύμητες ενέργειες που αναφέρθηκαν (σε ποσοστό ≥3% των ασθενών που έλαβαν inclisiran και με συχνότερη εμφάνιση από ό,τι με το εικονικό φάρμακο) ήταν αντίδραση στο σημείο της ένεσης, αρθραλγία, ουρολοίμωξη, διάρροια, βρογχίτιδα, πόνος στα άκρα και δύσπνοια. Από αυτά, τα συχνότερα ήταν οι αντιδράσεις στο σημείο της ένεσης. Αυτές ήταν σε γενικές γραμμές ήπιας μορφής, ενώ καμία δεν ήταν σοβαρής μορφής ή εμμένουσα.